LEUCOCITOSIS CON NEUTROFILIA: MÁS ALLÁ DE LA INFECCIÓN
Fabricio Andrés Lasso Andrade1, Diego Fernando Dorado2, Tomás Omar Zamora3
Resumen
El hallazgo de leucocitosis con neutrofilia se ha asociado clásicamente a un origen infeccioso, aunque existen muchas otras condiciones benignas o malignas que pueden producir este hallazgo en el hemograma. Se deben tener en cuenta las causas de pseudoleucocitosis como el agrupamiento de plaquetas por el anticoagulante ácido dietilenediaminotetraacético (EDTA) que se presenta también como una causa de pseutrombocitopenia, además de la pseudoleucocitosis que se presenta en las crioglobulinemias. Existen causas primarias como la neutrofilia hereditaria crónica, trastorno genético que se caracteriza por tener activado el gen del CSF3 (factor estimulante de colonias de granulocitos) produciendo proliferación de neutrófilos, así también en los neonatos con síndrome de Down se presenta un recuento aumentado de leucocitos como parte del Trastorno mieloproliferatio transitorio, que en la mayoría de veces es autolimitado. La leucocitosis con neutrofilia se presenta como un desafío para el médico, dando la imperiosa necesidad de una búsqueda meticulosa de sus causas reales, las cuales pueden ser espurias, primarias o secundarias; el clínico debe basar su aproximación diagnóstica en una adecuada historia clínica y un acucioso examen físico. En ese contexto, la presente revisión narrativa persigue como objetivo dar a conocer las diferentes causas de la leucocitosis con neutrofilia tendiente a describir una aproximación clínica para su abordaje diagnóstico.
Palabras clave: Hemograma; leucocitosis; infección.
_______________________
1 MD. Universidad del Cauca, Facultad Ciencias de la Salud. Popayán, Colombia.
2 MD. Universidad del Cauca, Facultad Ciencias de la Salud. Popayán, Colombia.
3 MD. MSP. Universidad del Cauca, Facultad de Ciencias de la Salud. Popayán, Colombia.
________________________
LEUKOCYTOSIS WITH NEUTROPHILIA: BEYOND THE INFECTION
Abstract
The finding of leukocytosis with neutrophilia has been classically associated with an infectious origin, although there are many other benign or malignant conditions that can produce this finding in the hemogram. The causes of pseudoleukocytosis must be taken into account, such as the clustering of platelets by the anticoagulant diethylenediaminetetraacetic acid (EDTA), which also appears as a cause of pseutenombopenia, in addition to the pseudoleukocytosis that occurs in cryoglobulinemia, which can even present as the first finding of these diseases. There are primary causes such as chronic hereditary neutrophilia, genetic disorder that is characterized by having activated the gene of G-CSF (Granulocyte colony stimulating factor) producing proliferation of neutrophils, so also in neonates with Down syndrome there is an increased white blood cell count. As part of the transient myeloproliferative disorder, which in most cases is self-limiting. Leukocytosis with neutrophilia is presented as a challenge to the physician, giving the urgent need for a meticulous search for its real cause, which can be spurious, primary or secondary; the clinician must base his diagnostic approach on an adequate clinical history and a thorough physical examination. In this context, the present narrative review aims to raise awareness of the different causes of leukocytosis with neutrophilia lieutenant to describe a clinical approach for its diagnostic approach.
Keywords: Blood count; Leukocytosis; infection
Introducción
El hemograma es junto con el uroanálisis, la prueba de laboratorio más solicitada por el médico. Nos aporta información cualitativa y cuantitativa de las líneas hematopoyéticas mieloide y linfoide. Dicha información se reporta bajo 3 parámetros a saber: eritrograma, trombograma y leucograma. El valor del rango normal de células en el leucograma es de 4.400 a 11.000 células/µL en adultos, en los niños varía de acuerdo a la edad. La alteración más frecuente en este parámetro es la leucocitosis, que se define como: conteo de leucocitos mayor a dos desviaciones estándar sobre la media o un valor mayor a 11.000 células/µL en adultos. La leucocitosis con neutrofilia es la asociación más común de leucocitosis, y se define como: Leucocitosis con más de 11.000 células/ µL y un conteo absoluto de neutrófilos por encima de dos desviaciones estándar sobre la media o mayor a 7.700 células/ µL (1-3).
Metodología
Esta revisión narrativa se basó en una estrategia de búsqueda que se realizó en bases de datos como PubMed/ Medline, Lilacs y Redalyc, EBSCO. Se emplearon los tesauros MeSH y DeCS con las palabras clave blood count, leukocytosis, infection. Se incluyeron artículos como ensayos clínicos, revisiones sistemáticas, revisiones de tema entre los años de 1955 y 2017, de los cuales se escogieron 70 que cumplían con la calidad según las listas de chequeo CONSORT, PRISMA y STROBE de 102 artículos encontrados, resultado de la búsqueda con las palabras clave.
Para efectos de este artículo, se abordarán las causas de leucocitosis con neutrofilia y se describirá una aproximación clínica para su abordaje diagnóstico como se señala en la Figura 1.
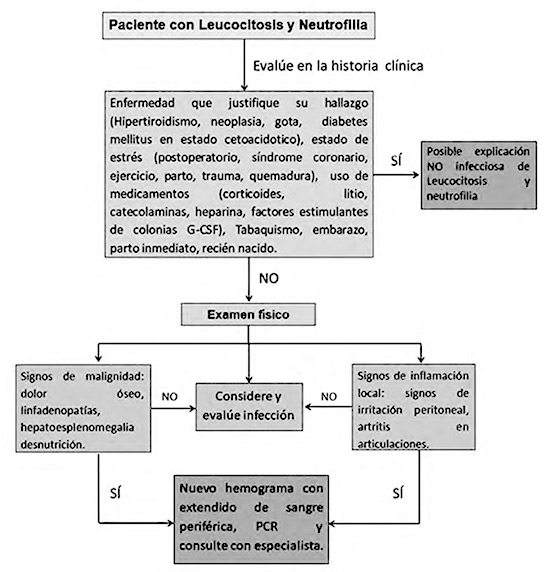 |
Figura 1. Algoritmo para la aproximación diagnóstica de un paciente con Leucocitosis y neutrofilia. Fuente: Elaboración propia. |
Las Pseudoleucocitosis y Neutrofilias
Agrupamiento de plaquetas
La agregación plaquetaria que resulta debido al anticoagulante ácido dietilenediaminotetraacético (EDTA), es ampliamente conocida y fue descrita inicialmente por Gowland en 1969 (4). Este fenómeno resulta de un agrupamiento de plaquetas por anticuerpos (IgG principalmente) aglutinantes de plaquetas, lo que hace que existan una condensación plaquetaria que no es detectada dentro del rango normal del volumen plaquetario (2-20 fL) en los contadores automatizados, si no como leucocitos, resultando en una pseudoleucocitosis. Su prevalencia oscila entre 0,1% y 2% en la población hospitalizada y hasta el 17% de pacientes ambulatorios. No se asocia a sexo, edad, fármacos ni otra patología; su importancia radica en el uso de exámenes y tratamientos innecesarios (4-9).
Crioglobulinemias
La presencia de inmunoglobulinas que presentan una precipitación reversible a temperaturas menores de 37°C, usualmente asociadas a la infección por el virus de la hepatitis B, en especial las crioglobulinemias mixtas tipo II y III, las que producen recuentos falsamente elevados de leucocitos, plaquetas y eritrocitos, pueden llegar a presentarse como reacciones leucemoides (leucocitos >50.000 células/µL) tan altas con valores de hasta 255.000 células/µL. Es así que la pseudoleucocitosis puede ser la primera manifestación de crioglobulinemia (10-12).
Causas primarias
Neutrofilia hereditaria crónica
Es un trastorno genético muy raro autosómico dominante, asociado al gen CSF3, que constitutivamente activa el receptor del G-CSF (factor estimulante de colonias de granulocitos), produciendo proliferación y diferenciación de neutrófilos. Este trastorno se asocia a episodios que caracterizan a un síndrome de respuesta inflamatoria sistémica como fiebre, taquicardia y disnea, además de derrame pleural y derrame pericárdico. El recuento de leucocitos puede llegar a ser elevado como mayor a 100.000 células/µL con neutrofilia en el 75% y formas inmaduras. Este es un diagnóstico de exclusión y se basará en el contexto clínico y pruebas moleculares (13).
Síndrome de Down
Los neonatos con síndrome de Down pueden presentar leucocitosis con neutrofilia, desviación a la izquierda con formas inmaduras (blastos), patología denominada trastorno mieloproliferativo transitorio (TMT), pero que es indistinguible de una Leucemia mieloide aguda; a diferencia de este último, el TMT resuelve espontáneamente sin terapia antileucémica. Su diagnóstico se hará con la exclusión de leucemia aguda mediante pruebas citogenéticas, inmunofenotípicas y moleculares (mutación de GATA-1) (14,15).
Síndromes de deficiencia de adhesión leucocitaria
Son el resultado de la falta o disfunción de moléculas de adhesión, lo que ocasiona que exista un recuento periférico de leucocitos elevados, pero con una falla en la migración hacia los tejidos. A su vez, ello resulta en una falla de la defensa del huésped e infecciones a repetición, especialmente por Staphylococcus aureus, organismos entéricos gram negativos y hongos (16,17).
Causas secundarias
El estrés
La gran mayoría de los neutrófilos están almacenados en la médula ósea, solo un pequeño porcentaje se encuentran en el plasma. Sin embargo, más de la mitad de estos se encuentran adheridos (marginados) al endotelio vascular. Ante situaciones de estrés físico o emocional como ejercicio intenso, cirugías, trauma, convulsiones, inyección de epinefrina, entre otras (18-20), se produce un aumento de catecolaminas (21) haciendo que estos neutrófilos se liberen del endotelio vascular. Ello causa una elevación modesta en el número de los mismos, lo que es apoyado por el hecho de que algunos casos de neutrofilia inducia por estrés pueden ser bloqueados por los antagonistas β-adrenérgicos como el propanolol (22). Sin embargo, la neutrofilia generada por el ejercicio no se ve afectada por estos fármacos (23), por lo cual se ha sugerido que la alteración del flujo y la mecánica de los neutrófilos alojados en los pulmones tienen un rol importante en la neutrofilia inducida por el ejercicio (24).
Infección aguda
La infección aguda es una de las principales causas no malignas de leucocitosis (18). La respuesta inflamatoria aguda aumenta la permeabilidad vascular y la migración de leucocitos desde la circulación hasta el sitio de la lesión. Además ante estados de inflamación e infección se liberan neutrófilos desde la reserva de la médula ósea, lo cual produce un aumento significativo del número de estos en la circulación sanguínea. Este proceso es generado por productos bacterianos, citoquinas y quimiocinas producidas en el sitio de la inflamación (25). Normalmente los neutrófilos tienen una vida media de 6,5 horas. Algunas citoquinas (IL-1B, TNF, IL-6, IFN-y, G-CSF, GM-CSF) y el lipopolisacárido pueden prolongar este tiempo (26), contribuyendo al desarrollo de un estado de neutrofilia. En infecciones bacterianas moderadas y severas, la neutrofilia se asocia con liberación de formas inmaduras de neutrófilos desde la medula ósea, que resulta en una desviación a la izquierda. También se encuentra la presencia de granulaciones toxicas y cuerpos de Döhle en los neutrófilos, con una mayor sensibilidad para la detección de infección bacteriana aguda (27). En este sentido, es importante que un paciente que se presenta con fiebre y neutrofilia sea evaluado para descartar las causas bacterianas más comunes de infección.
Los fármacos
Varios medicamentos pueden producir una elevación moderada del recuento de neutrófilos en sangre. Los
glucocorticoides son los principales fármacos que producen una neutrofilia moderada. Esto gracias a que prolongan el tiempo de sobrevida de los neutrófilos y además tiene un efecto estimulante sobre el G-CSF (28-30). El litio es un medicamento utilizado en psiquiatría como estabilizador del ánimo, que también produce neutrofilia, incluso se ha documentado su uso en estados de neutropenia severa; así también, este medicamento eleva las plaquetas y células CD34+ (31,32). La heparina produce una leucocitosis con linfocitosis y neutrofilia en el 0,44% de los pacientes, esta última por inhibición de las selectinas y demarginación vascular. Dado su amplio uso en la clínica, es un dato a tener en cuenta para determinar estados verdaderamente infecciosos (33). Las catecolaminas y los Beta-agonistas pueden producir neutrofilia por demarginación vascular, como en la liberación de catecolaminas inducida por el ejercicio (34).
Factores recombinantes como la IL-6 recombinante humana, producen neutrofilia por demarginación y liberación acelerada de la médula ósea (35). El G-CSF recombinante humano también produce una elevación de los neutrófilos y se usa como tratamiento para neutropenias severas (36-37). Además, drogas ilegales como la cocaína y las anfetaminas también se han asociado a neutrofilias leves (38).
Los trastornos metabólicos, inflamatorios y autoinmunes
Trastornos metabólicos como la cetoacidosis diabética se ha relacionado con un aumento en el número de glóbulos blancos sin evidencia de infección (39,40). Se considera que esto es producto de un estado de hipercortisolemia y aumento de la secreción de catecolaminas (41). Inclusive se han reportado casos de reacciones leucemoides (42,43). Sin embargo, un aumento mayor a 25.000 leucocitos o un porcentaje mayor a 10% de cayados hace necesario descartar un proceso infeccioso concomitante (44). La tormenta tiroidea, una alteración severa de la función tiroidea, que tiene como origen múltiples causas, entre ellas las crisis hiperglicémicas, también muestra dentro de sus hallazgos leucocitosis con neutrofilia (45).
Dentro de las enfermedades inflamatorias crónicas, la enfermedad de Still del adulto, una enfermedad reumática de etiología desconocida, se presenta en un 80-90% con leucocitosis y neutrofilia (46,47). El síndrome de Sweet, considerado como el prototipo de las dermatosis neutrofílicas, hace referencia a un grupo de patologías dermatológicas que se caracterizan por placas sensibles o dolorosas, con un infiltrado neutrofílico, fiebre y leucocitosis con neutrofilia (48,49). La enfermedad de Kawasaki, una vasculitis que afecta a vasos pequeños y medianos, también se ha asociado a un incremento en el número de leucocitos a expensas del aumento de formas inmaduras de los granulocitos (50,51). Se destaca también, la presencia y el rol fisiopatológico de la leucocitosis con neutrofilia en patologías crónicas como la hepatitis alcohólica (52). Los trastornos autoinmunes, entre los que resaltan el Lupus Eritematoso Sistémico (LES) y la Artritis Reumatoide, se asocian con un aumento en el número de neutrófilos con alteración en sus funciones, lo cual juega un papel importante en la fisiopatología de estas enfermedades (53,54).
La Asplenia
La leucocitosis con neutrofilia se puede presentar posterior a una esplenectomía o trauma esplénico (55,56). El mecanismo es poco entendido, se cree que es por disminución de su salida a los tejidos periféricos. El hallazgo de neutrofilia es común, pues se piensa que es el primer cambio reflejado en el recuento de glóbulos blancos, al menos durante los primeros 3 meses, luego de lo cual el recuento decrece y el predominio será de linfocitos (57-59). En los pacientes con esplenectomía postraumática la complicación más temida es la sepsis. Se ha demostrado que en estos pacientes el recuento de leucocitos es alto en los primeros días, tanto en quienes desarrollan sepsis como en quienes
no. A partir del quinto día, el recuento de leucocitos es mucho mayor en quienes si desarrollan sepsis, particularmente en el rango de 15.000 a 20.000 células/ uL, por lo que no se debe considerar como un evento fisiológico (60).
Las Neoplasias
Las neoplasias hematológicas y no hematológicas se pueden presentar con leucocitosis con neutrofilia. En tumores sólidos como el cáncer gástrico, de mama y de cuello uterino, la leucocitosis se puede presentar hasta en el 25,6% de los casos e incluso en el cáncer de cuello uterino es un factor pronóstico independiente (p = 0,007) (61). En Neoplasias mieloproliferativas como la Leucemia mieloide crónica (LMC), la leucocitosis es un hallazgo común, generalmente con un recuento de leucocitos mayor a 100.000 células/µL a expensas de formas inmaduras de neutrófilos. En las series reportadas para LMC infantil, los recuentos varían entre 250.000 y 750.000 células/µL (62-64).
El Tabaquismo
El fumar cigarrillo es tal vez la causa más frecuente de leucocitosis con neutrofilia en adultos. La neutrofilia leve se observa en 11,5% de los fumadores, en comparación con el 1,5% de los no fumadores (65). El número de cigarrillos consumidos al día y la duración del consumo, especialmente un consumo mayor a 5 años, se presenta como un mayor recuento de leucocitos (p <0,05) (66). El conteo aumentado de leucocitos puede persistir incluso de 2 a 5 años después del cese del consumo (67,68).
La Obesidad
La obesidad se asocia a neutrofilia crónica (69), se considera como un estado inflamatorio de bajo grado donde los adipocitos producen y liberan citoquinas proinflamatorias como IL-1, IL-6, TNF-alfa, las cuales generan un estado inflamatorio que es causa de neutrofilia (70).
Conclusiones
La leucocitosis con neutrofilia se asocia con causas infecciosas y no infecciosas, así como con enfermedades benignas o malignas que la convierten en un real desafío diagnóstico para el clínico. Éste debe elaborar en primera instancia, una adecuada historia clínica y un prolijo examen físico a fin de determinar un correcto estudio de la misma y así establecer su causa para, de esta manera, establecer un adecuado tratamiento. Sin embargo, en muchas ocasiones su causa no se puede identificar. De modo que en esta situación, el manejo debe ser multidisciplinario y referenciando a un centro de mayor complejidad, lo que resultará en un mejor pronóstico para el paciente.
Conflicto de interés
Los autores declaran no tener ningún conflicto de interés.
Financiación
Ninguna declarada por los autores.
Agradecimientos
Los autores expresan su agradecimiento a la Universidad del Cauca, en especial al departamento de Medicina Interna.
Referencias
1. Mónica Torrens P. Interpretación Clínica Del Hemograma. Rev. Med. Clin. Condes. 2015; 26 (6): 713-725.
2. Germán Campuzano Maya. Del hemograma manual al hemograma de cuarta generación. Medicina & Laboratorio. 2007; 13: 11-12.
3. Thomas D Coates. Approach to the patient with neutrophilia – UpToDate. Post TW (Ed), UpToDate, Waltham, MA. (Acceso en Marzo 04/2017).
4. Gordan HG, Larson NL. Use of sequestrene as an anticoagulant. Am J Clin Pathol. 1955; 23: 613-18.
5. Berkman N, Michaeli Y, Or R, Eldor A. EDTA-dependent pseudothrombocytopenia: A clinical study of 1 8 patients and a review of the literature. Am J Hematol. 1991; 36: 195.
6. Solanki DL, Blackburn BC. Spurious leukocytosis and thrombocytopenia. A dual phenomenon caused by clumping of platelets in vitro. JAMA. 1983; 250: 2514.
7. Savage RA. Pseudoleukocytosis due to EDTA-induced platelet clumping. Am J Clin Pathol. 1984; 81: 317.
8. Bizarro N. EDTA-dependent pseudothrombocytopenia: a clinical and epidemiological study of 112 cases, with 10-year follow-up. Am J Hematol. 1995; 50: 103-109.
9. Carvajal-Vega, Edgar; Padilla-Cuadra, Juan I.; LópezVillegas, Jorge; Mata-Sánchez, María del Milagro. Pseudotrombocitopenia por EDTA en paciente con polineuropatía desmielinizante inflamatoria crónica. Acta Méd Costa. 2016; 58 (2): 84-87.
10. Winfield JB. Cryoglobulinemia. Hum. Pathol. 1983; 14: 350-354.
11. Yadav YK, Aggarwal R, Gupta O, S. Ranga hepatitis-B crioglobulinemia asociada se presenta como pseudoleucocytosis. J Lab Physicians. 2011; 3: 133-5.
12. Patel KJ, Hughes CG, Parapia LA. Pseudoleucocytosis and pseudothrombocytosis due to cryoglobulinaemia. J Clin Pathol. 1987; 40: 120.
13. Plo I et al. An activating mutation in the CSF3R gene induces a hereditary chronic neutrophilia. J Exp Med. 2009; 206 (8): 1701. Epub 2009 Jul 20.
14. Zipursky A. Transient leukemia—a benign form of leukaemia in newborn infants with trisomy 21. Br J Haematol. 2003; 120: 930-938.
15. Gosavi AV, Murarkar PS, Lanjewar DN, Ravikar RV. Tranisent leukemia in Down syndrome: report of two cases with review of literature. Indian J Hematol Blood Transfus. 2011; 27: 172-176.
16. M Madkaikar, Z Currimbhoy, M Gupta, M Desai and M Rao. Clinical Profile of Leukocyte Adhesion Deficiency Type I. Indian Pedia. January 16, 2012; 49.
17. Etzioni A. Leukocyte Adhesion Deficiency (LAD) Syndromes. Orphanet Encyclopedia, July 2005.
18. Wendy S, Hoffman R. White blood cells 1: non-malignant disorders. Lancet. Apr 15, 2000; 355 (9212): 13517.
19. Widick, MD, Eric S. Winer, MD Leukocytosis and Leukemia. Prim Care Clin Office Pract. 2016; 43: 575–587.
20. Pedersen B K, Rohdeand K., Ostrows KI.Recovery of the immune system after exercise. s.l.: Ac Phy Scand. 1998; 162: 325-332.
21. Timo Heidt et al. Chronic variable stress activates hematopoietic stem cells. Nat Med. 2014; 20: 754–758.
22. Que Deng et al. Psychological stress promotes neutrophil infiltration in colon tissue through adrenergic signaling in DSS-induced colitis model. Brain Beha Immu, 2016, Vol. 57 243-254.
23. John Q, William l. The Effects of Acute Exercise on Neutrophils and Plasma Oxidative Stress. Off J Ameri College of Sp Med. 2003; Vol. Medicine & science in sports & exercise.
24. D. C. Nieman, et all. Effects of Long-Endurance Running on Immune System Parameters and Lymphocyte Function in Experienced Marathoners. Int J Sports Med. 1989; 10: 317-323.
25. Furze Rebecca C., Rankin S. Neutrophil mobilization and clearance in the bone marrow. Black Publi, Immu. 2008; 125: 281-288.
26. Colotta F. et al. Modulation of granulocyte survival and programmed cell death by cytokines and bacterial products. Blood. 1992; 80: 2012-2020.
27. Layla A. Al-Gwaiz, Hanan H. Babay. The Diagnostic Value of Absolute Neutrophil Count, Band Count and Morphologic Changes of Neutrophils in Predicting Bacterial Infections. Med Princ Pract. 2007; 16: 344–347.
28. CoxG. Glucocorticoid treatment inhibits apoptosis in human neutrophils. J Immunol. May 1, 1995; 154 (9): 4719-25.
29. Liles WC, Huang JE, Llwellyn C, Sengupta D, Price TH, Dale DC. A comparative trial of granulocyte-colony-stimulating factor and dexamethasone, separately and in combination, for the mobilization of neutrophils in the peripheral blood of normal volunteers. Transfusion. 1997; 37: 182–187.
30. Dale DC, Fauci AS, Guerry DI, et al. Comparison of agents producing a neutrophilic leukocytosis in man. Hydrocortisone, prednisone, endotoxin, and etiocholanolone. J Clin Invest. 1975; 56 (4): 808–13.
31. Kast RE, 2008, Burlington, VT, USA. How lithium treatment generates neutrophilia by enhancing phosphorylation of GSK-3, increasing HIF-1 levels and how this path is important during engraftment. B Marrow Trans. 2008; 41: 23–26.
32. Focosi D. Azzara A. Kast RE. Carulli G. Petrini M. Lithium and hematology: established and proposed uses. J of Leu Biol. January, 2009; 85.
33. Zhang S, Condac E, Qiu H, Jiang J, Gutierrez-Sanchez G, Bergmann C, Handel T, Wang L. Heparin-induced Leukocytosis Requires 6-O-Sulfation and Is Caused by Blockade of Selectin- and CXCL12 Protein-mediated Leukocyte Trafficking in Mice. J Biol Chem. Feb 17, 2012; 287(8): 5542–5553.
34. Benschopa RJ.Rodriguez-Feuerhahnb M. Schedlowskib M. Catecholamine-Induced Leukocytosis: Early Observations, Current Research, and Future Directions. Brain Behav Immun. Jun, 1996; 10 (2): 77-91.
35. Tatsushi Suwa, James C. Hogg, Dean English, Stephan F. Van Eeden Interleukin-6 induces demargination of intravascular neutrophils and shortens their transit in marrow. Am J Physiol Heart Circ Physiol. 2000; 279 (6): H2954-H2960.
36. Welte, K., & Boxer, L. A. Severe chronic neutropenia: Patho and therapy Seminars Hemato. 1997; 34 (4): 267278.
37. Bonilla M. A. et al Long-term safety of treatment with recombinant human granulocyte colony-stimulating factor
(r-metHuG-CSF) in patients with severe congenital neutropenias. Brit J of Haema. 1994; 88: 723–730.
38. Richards JR, Farias VF, Clingan CS. Association of leukocytosis with amphetamine and cocaine use. S World J. 2014; 207651.
39. Flodd RG, Chiang VW. Rate and prediction of infection in children with diabetic ketoacidosis.Am J Emerg Med. Jul, 2001; 19 (4): 270-3.
40. Wei Xu, Hai-feng Wu, Shao-gang Ma, Feng Bai, Wen Hu, Yue Jin, Hong Liu. Correlation between Peripheral Blood Cell Counts and Hyperglycemic Emergencies. Int. J. Med. Sci. 2013; 10.
41. Stentz FB, Umpierrez GE, Cuervo R, Kitabchi AE. Proinflammatory cytokines, markers of cardiovascular risks, oxidative stress, and lipid peroxidation in patients with hyperglycemic crises. Diabetes. 2004; 53 (8): 2079.
42. Obi N, Katabami T, Asai S, Saito N, Tanaka Y. Fulminant type 1 diabetes complicated by leukemoid reaction. Intern Med. 2008; 47 (9): 847-51.
43. Burris AS. Leukemoid reaction associated with severe diabetic ketoacidosis. South Med J. May, 1986; 79 (5): 647-8.
44. Slovis CM, Mork VG, Slovis RJ, Bain RP. Diabetic ketoacidosis and infection: leukocyte count and differential as early predictors of serious infection. Am J Emerg Med. 1987; 5 (1): 1.
45. Alzamani Mohammad Idrose. Acute and emergency care for thyrotoxicosis and thyroid storm. Acu Med & Surg. 2015; 2: 147–157.
46. Pouchot J, Sampalis JS, Beaudet F, Carette S, Décary F, Salusinsky-Sternbach M et al. Adult Still’s disease: manifestations, disease course and outcome in 62 patients. Medicine (Baltimore). Mar, 1991; 70 (2): 118-36.
47. Alejandro Olivéa, Susana Holgadoa, Marta Vallsb. Enfermedad de Still del adulto. Rev Esp Reumatol. 2001; 28: 32-7.
48. Ginartea M, Toribioa J. Síndrome de Sweet. Med Clin. 2009; 133: 31-5.
49. Von den Driesch P. Sweet’s syndrome (acute febrile neutrophilic dermatosis). J Am Acad Dermatol. 1994; 31(4): 535.
50. Dong Soo Kim. Kawasaki Disease. Yon Medi J. 2006; 47 (6): 759 – 772.
51. Bayers, Stephanie et al. Kawasaki disease. J American A of Derma. 69 (4): 501.e1-501.e11.
52. Xu, Ruonan et al. “The Role of Neutrophils in the Development of Liver Diseases.” Cell and Mole Immuno. 2014; 11 (3): 224–231
53. Kaplan MJ. Role of neutrophils in systemic autoimmune diseases. Arthri, Res & Ther. 2013; 15: 219.
54. Smith CK; Kaplan MJ. The role of neutrophils in the pathogenesis of systemic lupus erythematosus. Curr Opin Rheuma. 2015; 27 (5): 448–453.
55. Spencer RP, Grimmond AP, Treschuk-Bahn J. Abdominal trauma with leukocytosis and Howell-Jolly bodies. Idiopathic functional asplenia. Clini Nucl Med. 1988; 13: 544.
56. Joyce RA, O’Donnell J, Sanghvi J, Westerman MP. Asplenia and abnormal neutrophil kinetics in chronic idiopathic neutrophilia. Am J Med. 1980; 69: 633–6.
57. Lipson RL, Bayrd ED, Watkins CH. The post-splenectomy blood picture. Am J Clin Pathol. 1959; 32: 526–32.
58. McBride JA, Dacie JV, Sharpley R. The effect of splenectomy on the leukocyte count. Br J Haematol. 1968; 14: 225–31.
59. Millard RE, Banerjee DK. Changes in T and B blood lymphocytes after splenectomy. J Clin Pathol. 1979; 32: 1045–9.
60. Konstantinos G. Toutouzas et al. Leukocytosis After Posttraumatic Splenectomy. A Physiologic Event or Sign of Sepsis? Arch Surg. 2002; 137 (8): 924-929.
61. Qiu MZ et al. Incidence of anemia, leukocytosis, and thrombocytosis in patients with solid tumors in China. Tumour Biol. Dec, 2010; 31 (6): 633-41.
62. Savage DJ Szydlo RM Chase Aet al. Clinical features at diagnosis in 430 patients with chronic myeloid leukaemia seen at a referral centre over a 16-year period. Br J Haematol. 1997; 96: 111–116.
63. Millot F Traore P Guilhot Jet al. Clinical and biological features at diagnosis in 40 children with chronic myeloid leukemia. Pediatrics. 2005; 116: 140–143.
64. Rowe JM Lichtman MA. Hyperleukocytosis and leukostasis: common features of childhood chronic myelogenous leukemia. Blood. 1984; 63: 1230–1234.
65. Stemmelin GR, Doti CA, Shanley CM, et al. Smoking as a cause for mild chronic neutrophilia. Blood. 2004; 104: 3796.
66. Besime Inal, Tuba Hacıbekiroglu, Bilger Cavus, Zeliha Musaoglu, Hatice Demir, and Berrin Karadag. Effects of smoking on healthy young men’s hematologic parameters. North Clin Istanb. 2014; 1 (1): 19–25.
67. Kawada T. Smoking-induced leukocytosis can persist after cessation of smoking. Arch Med Res. 2004; 35: 246.
68. Van Tiel E, Peeters PH, Smit HA, et al. Quitting smoking may restore hematological characteristics within five years. Ann Epidemiol. 2002; 12 (6): 378–88.
69. Weir AB, Lewis Jr JB, Arteta-Bulos R. Chronic Idiopathic Neutrophilia: Experience and Recommendations. South Med Journal. 2011; 104: 499-504.
70. Herishanu, Y., Rogowski, O., Polliack, A. and Marilus, R. Leukocytosis in obese individuals: possible link in patients with unexplained persistent neutrophilia. Euro J Haemato. 2006; 76: 516–520.
Recibido: 18 de diciembre de 2017
Aceptado: 14 de agosto de 2018
Correspondencia: Fabricio Andrés Lasso Andrade fabriciolasso@gmail.com